靶向CD19的嵌合抗原受体(CAR)T细胞在复发或难治性B细胞急性淋巴细胞白血病(R/RB-ALL)儿童患者中可获得持久的疾病缓解,因此美国食品药品监督管理局(FDA)已批准Tisagenlecleucel用于R/RB-ALL儿童患者。B-ALL的成人患者预后较差,靶向CD19CAR-T在成人B-ALL中的作用尚不清楚。CD19CAR-T在成人B-ALL中的临床试验结果显示了显著的免疫介导毒性,植入和缓解持续时间相对较短,并且需要使用异基因造血干细胞移植(Allo-SCT)进行巩固治疗。有研究者研发了一种新型的第二代CD19CAR-T细胞产品,具有快速脱落的特征,专为更多生理性T细胞激活而设计,以减少毒性并改善植入。基于此,研究者们开展了一项自体CAT19-41BB-ZCAR-T细胞(AUTO1)治疗R/RB-ALL成人的多中心I期临床研究。
研究方法
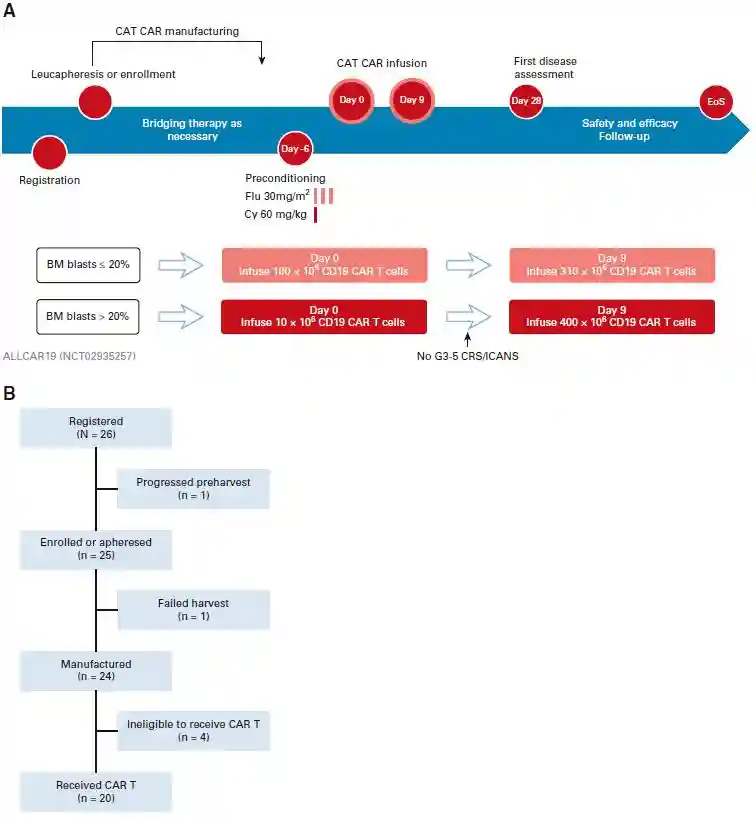
这项多中心、非随机、开放标签的I期临床研究在三个中心进行,纳入了20例R/RB-ALL成人患者。患者在进行白细胞分离和CAR-T生产后,患者接受氟达拉滨静脉给药(30mg/m2/天,共3天)和环磷酰胺(60mg/kg,单次给药)以进行淋巴细胞清除化疗(LD)。根据患者第0天骨髓(BM)中疾病负荷,原始细胞>20%的患者接受CAR-T细胞计数为10×106/kg,原始细胞≤20%的患者接受CAR-T细胞计数为100×106/kg。主要研究终点是CAR-T生产的安全性和可行性。次要研究终点包括疗效、CAR-T持续性、B细胞再生障碍和低丙球蛋白血症的发生率和持续时间以及1年和2年时的无事件生存(EFS)率和总生存(OS)率。
研究结果
1.患者和疾病特征
该研究共登记了26例患者中,有25例入组;其中1例登记患者因疾病快速进展而未继续入组。共24例有足够的CD3+T细胞用于生产CAR-T,并生成了符合预定标准的自体CAR-T产品。4例患者未输注,其中1例患者在贝林妥欧单抗桥接治疗后出现CD19阴性复发;1例患者出现移植物抗宿主病(GVHD),2例患者在疾病进展情况下死于感染;详见图1。20例顺利接受输注患者的人口统计特征详见见表1。中位年龄为41.5岁(范围为18-62岁);75%的患者具有异常核型,30%为Ph+疾病;患者既往接受过中位治疗线数为3线(范围为2-6),无既往接受过CAR-T治疗和中枢神经系统(CNS)受累的患者。
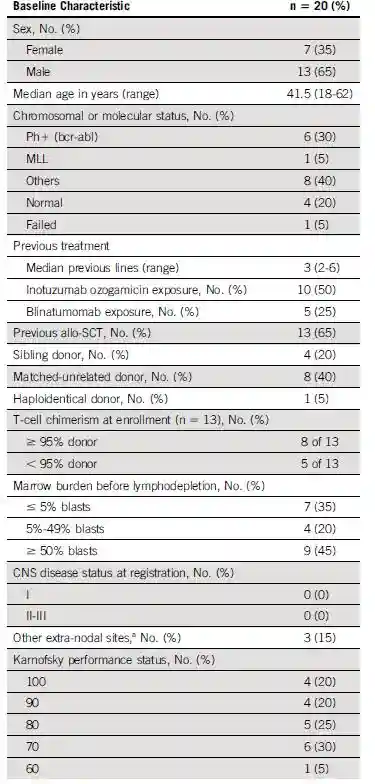
图1:ALLCAR19研究设计和招募
表1:ALLCAR19研究中的患者人口统计学特征
2.毒副反应
该研究中共有8/20例(40%)患者发生2级细胞因子释放综合征(CRS);3/20例(15%)发生1级CRS;尽管65%的患者LD前原始细胞>5%,但无患者发生≥3级CRS。11例CRS患者中的10例LD前原始细胞>5%,发生CRS的中位时间为输注后第6天,中位持续时间为4.5天。
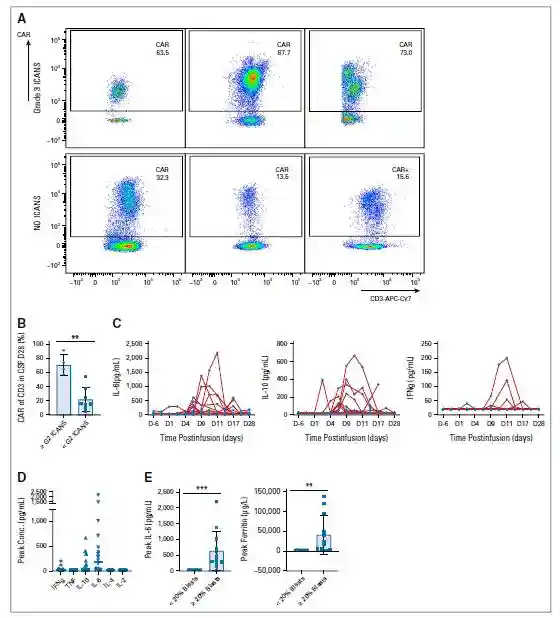
在4/20例(20%)患者中观察到免疫效应细胞相关神经毒性综合征(ICANS),其中3例(15%)为3级,但使用皮质类固醇后在24-72小时内消退至≤1级。ICANS的中位发生时间为输注后22天,中位持续时间为1.5天。在第28天对12例患者进行脑脊液(CSF)分析,包括发生ICANS的所有病例。在所有CSF样本中均可检测到CAR-T细胞(图2A),ICANS患者中CD3+CAR-T细胞的比例增加(图2B)。第28天CSF细胞因子较低,与相同时间点外周血(PB)中的结果一致(图2C)。
如果血清免疫球蛋白G水平≤4g/L,则开始静脉注射免疫球蛋白(IVIG)。20例患者中的2例在研究登记前接受IVIG。在其余18例患者中的13例在CAR-T后免疫球蛋白G水平≤4g/L的中位时间为2个月,5例开始IVIG治疗复发性感染。尽管63%的患者既往接受过异基因造血干细胞移植(Allo-SCT),但在研究中未观察到GVHD。
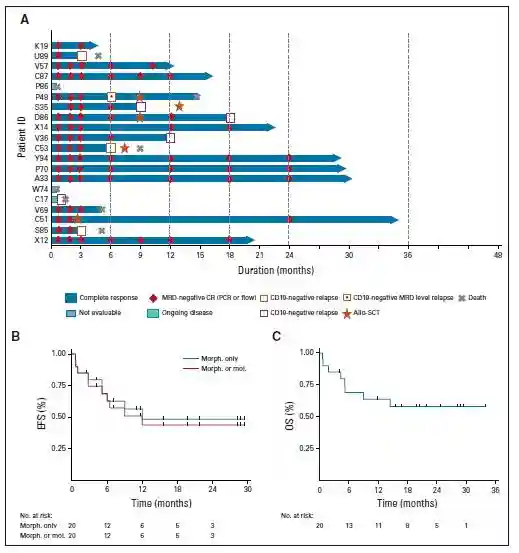
图2:ALLCAR19的毒副反应和细胞因子分泌情况
3.CAR-T细胞扩增和持久性

总体而言,观察到患者CAR-T细胞高水平扩增和持久性。CAR-T细胞扩增高峰为AUTO1输注后中位13天(范围为7-21天)。在qPCR扩增峰值时,通过流式细胞术测定的中位外周血(PB)CAR+T细胞百分数为83.7%(范围为5.71%-96.6%),中位CAR-T细胞绝对值(CAR/mL)为468(范围为88-8627)。
4.缓解率和生存期
共有17/20例(85%;95CI,62.1%-96.7%)患者在CAR-T治疗第1个月时达到微小残留病(MRD)阴性的完全缓解(CR);14/20例(70%;95%CI,45.7-88.1)患者在第3个月时仍处于MRD阴性的CR状态。其中有3例患者在缓解期间接受了Allo-HSCT。患者6个月和12个月以及24个月时的EFS率分别为68.3%(95%CI,42.4%-84.4%)和48.3%(95%CI,23.1%-69.7%)以及48.3%(95%CI,23.1%-69.7%);6、12和24个月时的OS率分别为69.1%(95%CI,43.6-84.8)、63.8%(95%CI,38.6-80.8)和58%(95%CI,33.1-76.4)(图3)。既往接受和未接受Allo-SCT的患者的OS和EFS无显著差异。
图3:ALLCAR19的缓解率和生存期
研究结论
AUTO1在R/RB-ALL成人患者中表现出可控的安全性、高缓解率和出色的CAR-T持久性。
参考文献:ClaireRoddie,JulianaDias,MaeveAO'Reilly,genReceptor-TTherapyi;JCO2100917.