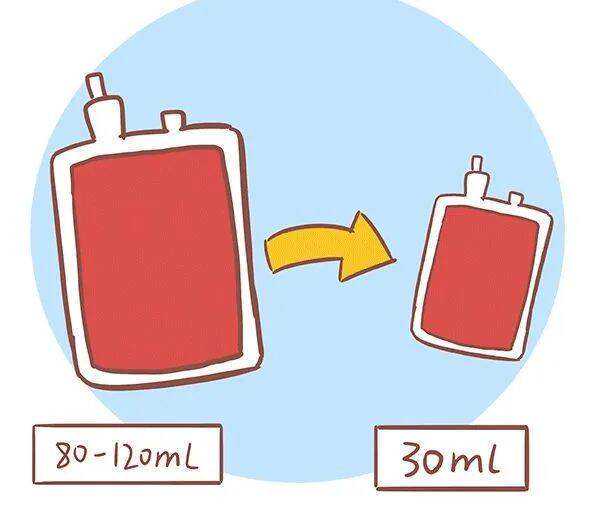
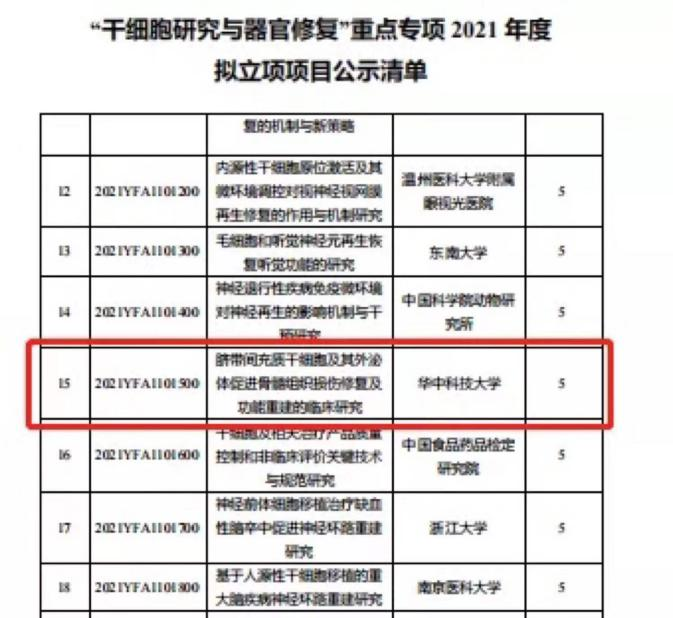
根据世界卫生组织发布的数据,新冠肺炎疫情已扩散至200个国家和地区,全球确诊病例累计超过46万例,死亡2万余例。作为潜在的疫苗和治疗靶标,SARS-CoV-2的核衣壳蛋白(nCoVN)在包装病毒基因组和病毒自组装中起作用。
2020年3月28日,广东省BeatingOrigin再生医学有限公司,中山大学,广州医科大学等多机构合作在预印版平台medRxiv在线发表未经同行评审的题为“TheNucleocapsidProteinofSARS-CoV-2AbolishedPluripotencyinHumanInducedPluripotentStemCells”的研究论文,该研究为了研究nCoVN对人诱导的多能干细胞(iPSC)的生物学作用,通过慢病毒表达系统产生了基因工程过表达nCoVN的iPSC(iPSC-nCoVN)。出乎意料的是,nCoVN表达两周后,iPSC的形态和增殖率发生了变化。
在iPSC-nCoVN中未检测到多能性标记SSEA4和TRA-1-81。同时,使用常规分化方案时,iPSC-nCoVN失去了分化为心肌细胞的能力。研究数据表明,nCoVN破坏了iPSC的多能性并将其转变为成纤维细胞,这为SARS-CoV-2的致病机理提供了新的见识。

严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)已被证明是COVID-19的病原体,与严重急性呼吸系统综合症冠状病毒(SARSCoV)的基因组具有79%的相似性。SARS-CoV-2中预测有12个编码区,包括刺突蛋白,核衣壳蛋白,包膜蛋白和膜蛋白。已经确定了刺突蛋白的冷冻EM结构,越来越多的证据表明,SARSCoV-2刺突蛋白结合人ACE2进入宿主细胞,这表明SARSCoV-2可能具有SARS-CoV相似的致病机制。由于对SARS-CoV-2的了解非常有限,因此基于先前对SARS-CoV的研究,试图了解SARS-CoV-2的生物学特性。
作为SARS-CoV中研究最多的蛋白质之一,核衣壳蛋白与病毒RNA结合,将基因组包装在核糖核蛋白颗粒中。与具有一定突变频率的刺突蛋白不同,核衣壳蛋白的序列更稳定,这意味着它是诊断工具和抗病毒治疗的理想靶标。据报道,在病毒体感染宿主细胞后,核衣壳蛋白抑制了I型干扰素的产生,这被认为是免疫逃逸的可能机制。核衣壳蛋白可抑制细胞胞质分裂和增殖,并调节多种途径,如转化生长因子-β信号转导,AP-1信号转导途径和NF-κB途径。另外,据报道,核衣壳蛋白在COS-1细胞和HPF细胞中是凋亡诱导剂。
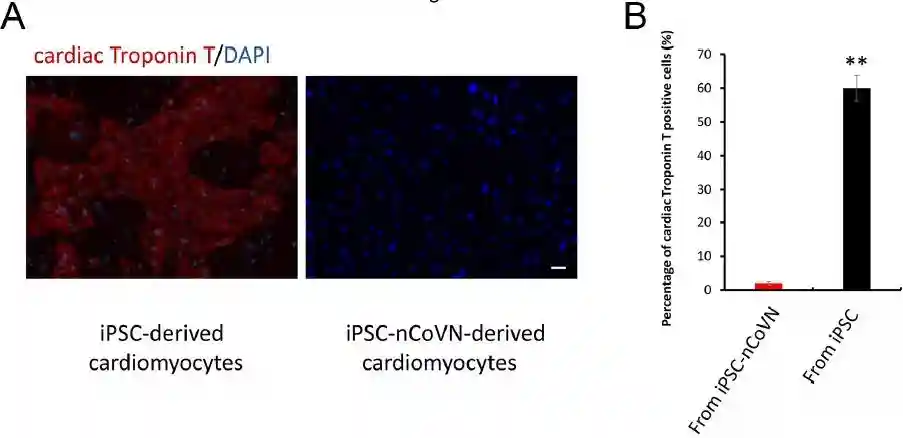
IPSC-nCoVN失去了心脏分化的能力
由于SARS-CoV-2的核衣壳蛋白与SARS-CoV的核衣壳蛋白具有88.1%的同一性,因此有理由推测它们在宿主细胞中具有相同的致病途径。为了研究nCoVN对人诱导的多能干细胞(iPSC)的生物学作用,通过慢病毒表达系统产生了基因工程过表达nCoVN的iPSC(iPSC-nCoVN)。出乎意料的是,nCoVN表达两周后,iPSC的形态和增殖率发生了变化。
在iPSC-nCoVN中未检测到多能性标记SSEA4和TRA-1-81。同时,使用常规分化方案时,iPSC-nCoVN失去了分化为心肌细胞的能力。研究数据表明,nCoVN破坏了iPSC的多能性并将其转变为成纤维细胞,这为SARS-CoV-2的致病机理提供了新的见识。
参考消息: