摘要
目的
结直肠癌共识分子分型(CMS)是基于肿瘤基因差异的分型,本文试图描述不同CMS分型患者的临床特点,以便指导结直肠癌的个体化诊疗。
方法
R语言软件下载纳入的7个GSE号的seriesmatrixfiles数据文件,该文件包含基因测序数据和患者的临床资料,共纳入1414例结直肠癌患者,采用CMScaller分型计算方法,根据纳入样本的基因表达谱,计算该样本的CMS归类,分为CMS1、CMS2、CMS3和CMS4四组,统计分析四组不同共识分型的临床特点差异,计量资料采取均数±标准差(Mean±SD)表示,计数资料以例(%)表示。采用进行统计学分析。
结果
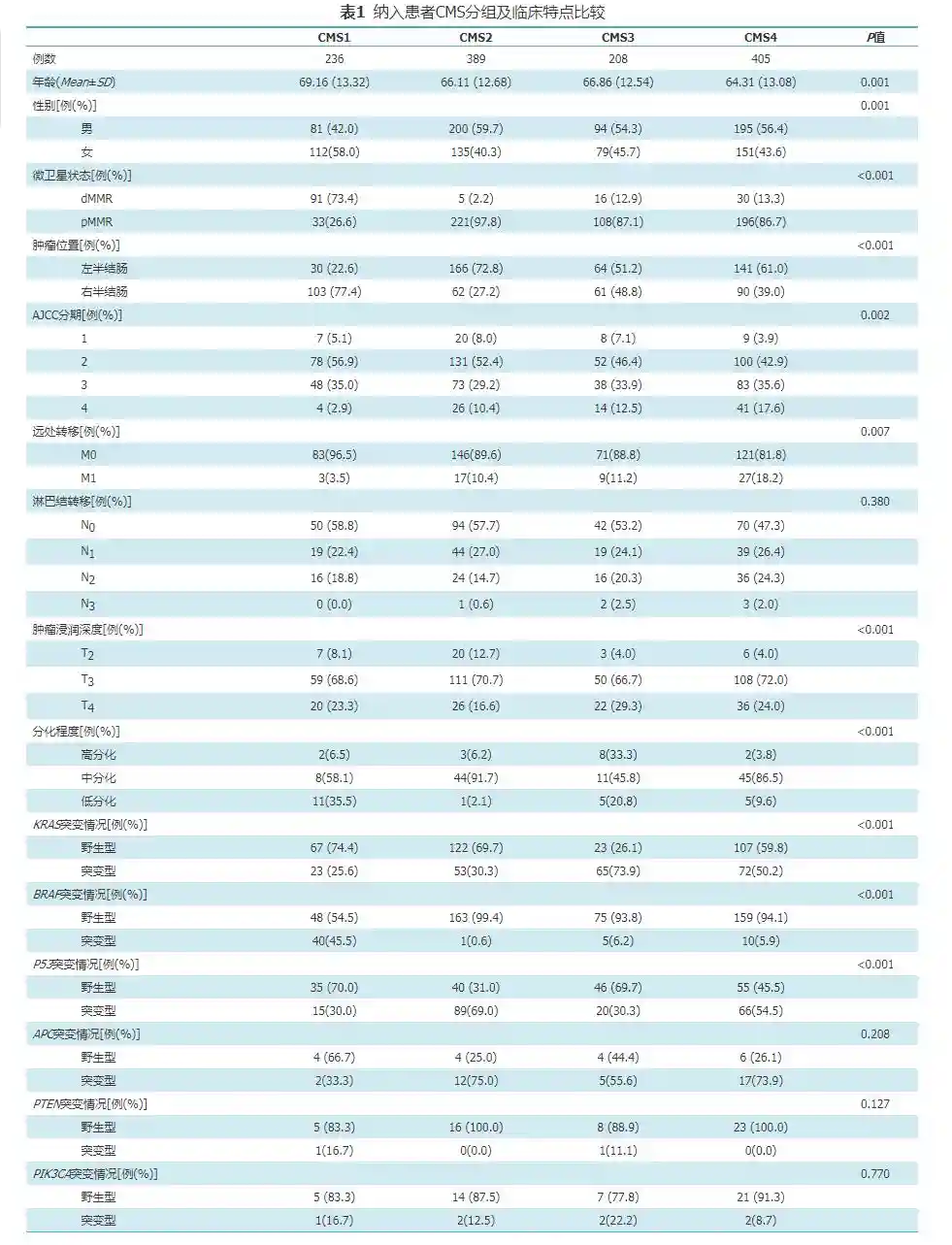
CMS1肿瘤多起源于右半结肠(77.4%),而CMS2则多源于左半结肠(72.8%)。CMS2肿瘤T4分期比例为16.6%,而其余三型T4分期比例分别为23.3%、29.3%和24%;CMS1发生远处转移的比例最低(3.5%),而CMS4远处转移率为18.2%。CMS1和CMS2中KRAS突变率低,分别为25.6%和30.3%,CMS3中KRAS突变率最高达73.9%;BRAF在CMS1中突变率最高为45.5%,而其余三型突变率分别为0.6%、6.2%和5.9%;基因APC的平均突变率为59.45%。总生存期和无进展生存期分析显示CMS4间质型最差,CMS2经典型相对预后最好。
结论
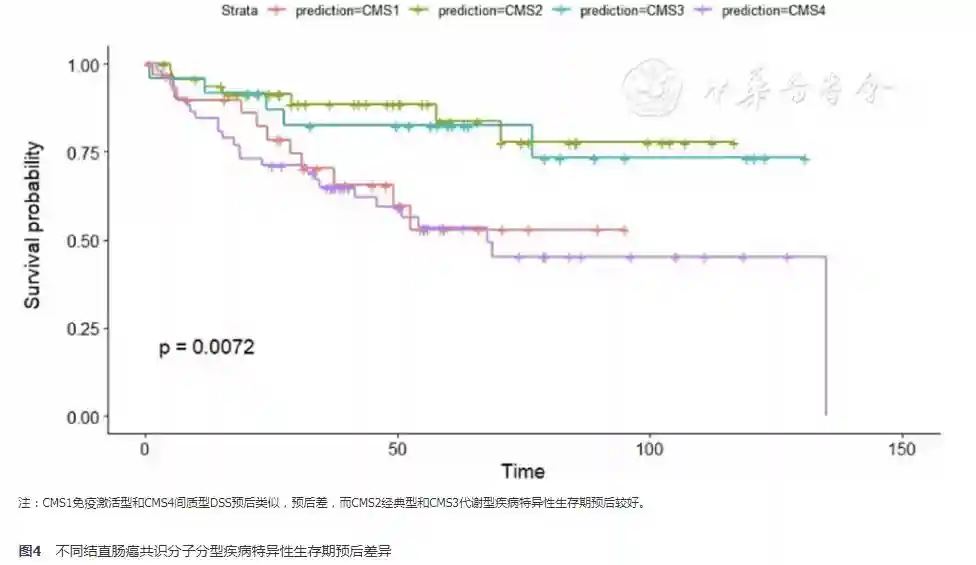
CMS1免疫型,高发右半结肠女性患者,高度微卫星不稳定性常常同时伴有BRAF基因突变,治疗困难,预后差。CMS2经典型,治疗效果良好,预后好。CMS3代谢性,治疗后肿瘤容易复发,但是化疗效果敏感,总体生存期预后尚可。CMS4间质型,高发于左半结肠,容易发生远处转移,该型患者预后最差。
结直肠肿瘤的发生发展是多阶段、多步骤、多基因突变的过程,最终成瘤的肿瘤组织具有高度异质性。传统的TNM分期不能很好的区分结直肠癌的异质性,已不能满足现在治疗的需求。在目前肿瘤靶向治疗、肿瘤免疫治疗等个体化治疗盛行的时代,亟需分子水平的结直肠癌分型用以指导诊疗。
随着高通量检测技术的发展,以及各种组学等方法的应用,已有研究者根据结直肠癌患者的测序数据,利用大数据的分析处理方法,提出多种结直肠癌分子分型的模型。2015年国际结直肠癌分型联盟提出的共识分子分型(Consensusmolecularsubtype,CMS)系统最具影响力。它综合既往6个独立的结直肠癌测序大数据,基于网络聚类分析方法,将结直肠癌分为5中CMS分子分型。CMS1为微卫星不稳定免疫激活型,表现为错配修复基因突变,微卫星不稳定。CMS2为经典型,Wnt和Myc信号通路异常活化,体细胞拷贝数变异显著。CMS3为代谢型,KRAS突变率高。CMS4为间质型,转化生长因子(Transforminggrowthfactorβ,TGF-β)信号通路异常激活。最后有13%的病例不能单独归为上述任何一类,成为混合型。
目前由于基因测序并未普及至常规应用,所以CMS分子分型自提出之后,并没有应用至临床实践中。不同CMS分型患者到底具有什么临床特点?尚需要进一步阐述。
1资料与方法
1.1一般资料
本文所有数据来自GEO数据库,共纳入7个数据系列,其序列号如下:GSE13067、GSE13294、GSE14333、GSE17536、GSE33113、GSE35896、GSE39582。R语言软件下载各个GSE号的seriesmatrixfiles数据文件,该文件包含基因测序数据和患者的临床资料,将其整理为一个统一的临床资料表格。本文纳入的临床资料项目包括:年龄、性别、肿瘤位置、TNM分期、肿瘤分化程度、是否辅助化疗、总生存期、复发与否、复发时间,以及KRAS、BRAF、APC、P53、PTEN、PIK3CA6个基因的突变情况,还包括肿瘤组织微卫星不稳定状态的信息。由于不同的序列所包含的临床资料项目并不完全相同,缺失的临床资料项目记录为NA。所有项目的统计分析,只纳入非NA数据,所以有时可见所分析的临床项目病例数总和并不等于纳入的所有1414例。
1.2共识分子分型方法
本文采用peter于2017年发表的CMS分型方法,根据每个纳入样本的基因表达谱,计算该样本的CMS归类,所有基因表达谱分析均采用R语言CMScaller包,具体R代码所在地址为:https:///Lothelab/CMScaller。纳入病例的基因表达谱数据,利用R语言从各个序列的seriesmatrixfile提取获得。
1.3统计学方法
采用软件进行统计学分析。计量资料采取均数±标准差(Mean±SD)表示,计数资料以例(%)表示。所有资料首先进行正态检验,如果数据呈正态分布,四组计量资料比较采用ANOVA,如果组间差异有统计学意义,进一步采用SNK方法进行两两比较;若不服从正态分布,组间比较采用Kruskal-WallisH检验,当组间比较有统计学差异时,进一步采用DSCF法进行多重比较。四组计数资料比较采用χ2分析。所有检验采用双侧检验,被认为差异具有统计学意义。
2结果
2.1一般资料及CMS分子分型的初步确认
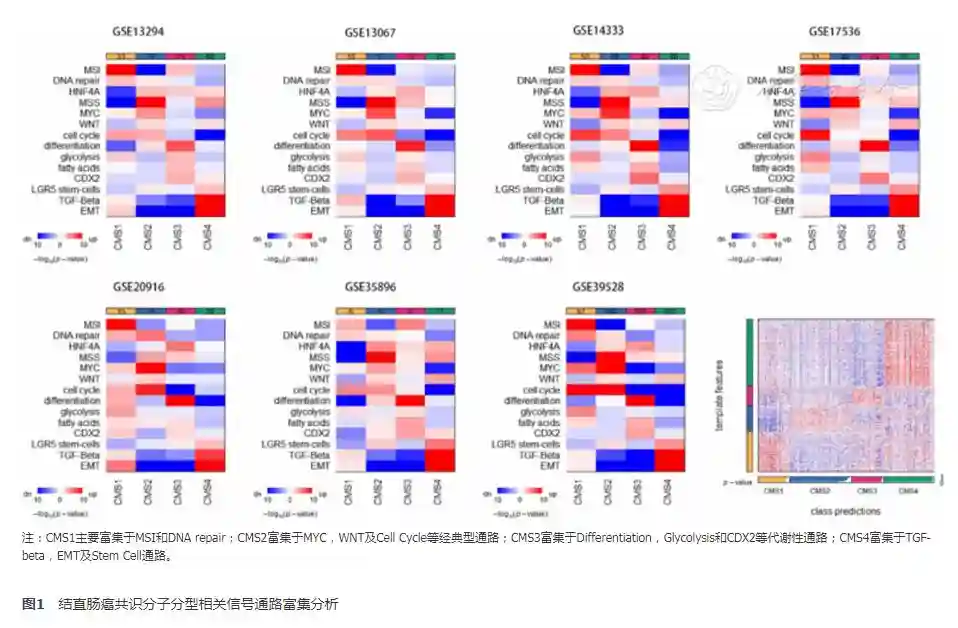
本项目共纳入7个GSE系列的1414例患者,根据基因表达芯片,通过CMScaller算法,最终有236例归类为CMS1型,389例归为CMS2型,208例归为CMS3型,405例归为CMS4型,以及176混合型。为了明确该分型方法的正确性,选取14个CMS分型的关键信号通路,对基因表达谱进行信号通路富集分析。
MSI、DNARepair,HNF4A及MSS主要为DNA损伤修复及微卫星稳定性相关通路,其在CMS1中异常富集;MYC,Wnt及CellCycle等调节细胞生长周期的通路,主要富集与CMS2病例;代谢相关通路Differentiation,Glycolysis,FattyAcids和CDX2则富集于CMS3代谢型;而TGF-beta,EMT及LGR5stemcell通路富集于间质型的CMS4,通路富集分析完全符合各型CMS的分子特征描述(见封四,图1),提示对纳入患者的CMS分类具有正确性。另外纳入部分患者具有微卫星稳定性状态的临床资料,本文也分析了4型CMS中出现dMMR的百分比,如表1所示,在CMS1中,dMMR发病率达73.4%,而其余3型中dMMR的发生率波动与2%~13%,进一步证明了分子分型的正确性。
2.2CMS与性别和年龄的关系
如表1所示,纳入患者的平均年龄在64~69岁,其中CMS1患者的年龄较CMS4患者稍高。关于性别比例,CMS1中女性患者占多数,而其余三型男性患者比例稍高。提示CMS1多见于年龄稍高的女性患者中,相较而言,CMS4患者发病年龄更低,多见于男性患者。
2.3CMS与肿瘤位置的关系
原发灶位于左半和右半结肠的肿瘤具有明显异质性,已有研究证实左半结肠癌和右半结肠癌具有不同的分子机制。分析各分子分型中左半和右半的构成比例,发现CMS1中右半的比例高达75.2%,而CMS2中左半的比例达70.3%,CMS3代谢型左右基本持平,CMS4间质型左半稍多于右半。
2.4CMS与肿瘤TNM分期的关系
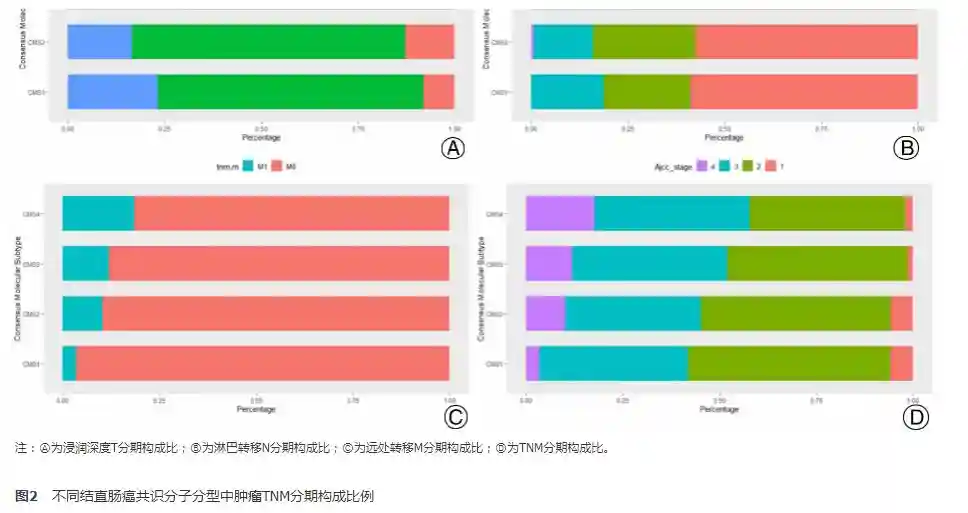
由于纳入病例的T分期中,Tis、T0及T1期病例数较少,只纳入T2、T3和T4期的病例进行分析。较其他三型而言,CMS2中T2浸润比例高,而T4浸润比例较低,提示CMS2经典型肿瘤局部侵袭性弱(图2Ⓐ)。而CMS3和CMS4中,T4浸润比例较高,提示代谢型和间质型肿瘤具有较高局部侵袭性。进而分析各型发生远处转移的比例,M1比例在CMS1最低为3.5%,在CMS4最高达18.2%,CMS2和CMS3居于两者之间(图2Ⓒ)。代谢型和间质型较微卫星不稳定型和经典型更容易发生远处转移。不同淋巴结转移分期在各个分子分型中构成比例差异无统计学意义。综合TNM分期,表现出CMS1早期患者居多,而CMS3和CMS4则晚期较多(图2Ⓓ)。
2.5CMS与KRAS、BRAF、p53、PIK3CA突变的关系
CMS3的KRAS突变率高达73.9%,远较其他三型的突变率高(25.6%~40.2%),提示CMS3代谢型患者靶向治疗存在一定限制。最常见的KRAS突变为:、和。CMS1的KRAS突变率为45.5%,相较而言其他3型的KRAS突变率仅仅波动于0.6%~6.2%。常见的KRAS突变为:。p53突变率在CMS1和CMS3中分别为30%和30.3%,而CMS2和CMS4中分别为69%和54.5%。另外常见基因PTEN、APC及PIK3CA突变率在各个分型中没有显著差别。APC为结直肠常见突变基因,突变率波动于33.3%~75%。但是PTEN和PIK3CA在结直肠中突变率非常低。
2.6CMS与预后
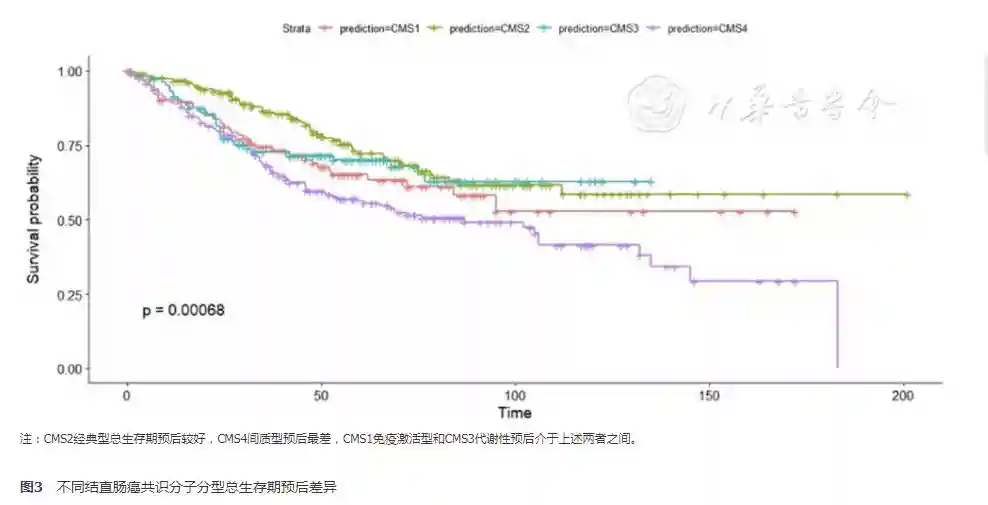
其中907例纳入病例具有预后随访资料,对其进行生存分析。CMS4间质型的总生存期最差,而CMS2经典型相对预后最好,CMS1微卫星不稳定型和CMS3代谢型总生存期预后介于上述两者之间(图3)。而进行疾病特异性生存分析,图4显示CMS1微卫星不稳定型和CMS4间质型预后差,而CMS2经典型和CMS3代谢型DSS预后相对较好。DFS分析结果基本同总生存率分析,CMS4间质型的总生存期最差,而CMS2经典型相对预后最好,CMS1微卫星不稳定型和CMS3代谢型总生存期预后介于上述两者之间(图5)。
3讨论
随着分子机制的深入研究和高通量检测技术的进展,以及个体化治疗理念的推广,肿瘤的分子分型日趋成为肿瘤诊疗的必要依据,例如乳腺癌的分子分型已广泛用于指导临床诊疗,其他肿瘤的分子分型研究如火如荼,包括胃癌、结直肠等消化道肿瘤。结直肠癌的分子分型已多达数种,多数基于结直肠癌组织基因表达谱,通过各种聚类分析得出,但是由于组织类型、检测方法及分析方法等不同,得出的分型方法各异。于是2015年国际结直肠癌分型联盟综合既往发表各种分型的原始数据,再分析后得出CMS分型。
由于目前基因高通量测序尚未普及,所以CMS分型只是停留在理论阶段,尚未应用于结直肠的临床诊疗。本文通过提取公开GEO数据库的临床数据和基因表达谱数据,根据基因表达谱将患者分为不同的CMS分子亚型,然后比较描述不同CMS亚型的临床特点,以期对分子分型作出相对具体的认识,进而指导患者的个体化治疗。
CMS1型为微卫星不稳定免疫激活型,多见于年龄约69岁女性患者,肿瘤多数位于右半结肠,肿瘤局部浸润较深,分化状态差,但较少发生远处转移,KRAS突变频率低,而BRAF突变频率高,其总生存期、无进展生存期预后较差。BRAF突变患者对标准化疗和EGFR靶向治疗反应性差,BRAF突变晚期患者为治疗难点,有报道联合抗BRAF、抗MEK及抗EGFR三联靶向治疗可以改善疗效。BRAF突变为该型患者预后较差的主要原因。
但是CMS1错配修复机制缺失发生率高,导致高频率的微卫星不稳定性以及肿瘤组织的免疫细胞浸润。由于肿瘤免疫治疗对dMMR肿瘤高反应性,预计针对CMS1的免疫治疗可以改善肿瘤预后。BRAF突变结直肠癌患者常常伴有MSI-H,所以推测对于BRAF突变的结直肠癌患者是否使用免疫治疗改善预后。针对BRAF突变的黑色素瘤,抗PD-1联合抗MEK可以改善预后。关于肿瘤免疫治疗在BRAF突变患者中的意义尚需临床研究证据。
CMS2型为经典型,患者平均年龄为66岁,男性患者占多数,肿瘤位置多位于左半结肠,肿瘤局部浸润较浅,多数为中分化程度,发生远处转移率较CMS1型高。该型患者治疗后疾病复发率低,总生存期预后最好。经典结肠癌基因APC和p53突变发生率较高,两者为结直肠癌发生发展过程早期驱动突变基因。APC为Wnt信号通路的抑制剂,APC突变导致Wnt通路异常激活,Wnt通路在保持干细胞特性方面,参与重要作用。lgr5是结肠干细胞的最重要分子标记,而lgr5是通过调节激活Wnt通路,来维持细胞的干细胞特性。CMS2型较少发生KRAS和BRAF突变,所以即使发生远处转移,尚可靶向药物治疗。另外该型患者很少发生错配修复机制缺失,所以微卫星状态为稳定型。
CMS3型为代谢型,发病平均年龄为66岁,男性和女性患者发病率基本持平,肿瘤位于左半和右半的发生率无显著差别,局部肿瘤浸润深度较深,分化程度较其他分型较好,远处转移率较低。KRAS突变率较高,BRAF突变率低。该型患者总生存期预后较好,但无疾病进展生存期较其他型差,提示治疗后肿瘤容易复发。KRAS目前主要作为靶向抗EGFR的敏感性预测标志物应用于临床。
除此之外,KRAS还与肿瘤的复发及预后相关,携带KRAS突变的结直肠癌患者预后差。合并KRAS突变的转移灶切除后,很容易再次复发,提示需要密切随访。本文数据提示CMS3型结直肠癌患者术后容易复发,但是总生存期预后较好。可能原因为该型患者对化疗的反应性较好,即使复发也可很好控制病情。
CMS4型为间质型,发病年龄在上述4型中最小,平均年龄为64岁,男性患者稍多于女性,肿瘤多位于左半结肠,浸润深度以T3为主,容易发生远处转移,TNM分期中Ⅳ期明显较其他3型增多,中等分化程度占多数,不管是无病生存期,还是总生存期,4型中预后最差。APC基因突变率较高,而BRAF基因突变率较低,KRAS和p53基因突变率约为半数。
该型肿瘤间质细胞中TGF-β分子信号通路异常激活,刺激肿瘤相关纤维母细胞分泌IL-11等细胞因子,从而有利于转移肿瘤细胞的定植。有研究证实TGF-β信号通路是结直肠癌远处转移必要条件,靶向抑制TGF-β信号通路,可以抑制结直肠癌转移灶的形成。另外该型肿瘤相关血管生成异常激活,促进了定植的转移肿瘤细胞增生和生长。抗血管生成药物贝伐单抗针对转移性结直肠癌的一线或二线治疗,可以明显改善总生存期。
4总结
CMS分子分型中各型各具特点,CMS1免疫型、高发右半结肠女性患者、高度微卫星不稳定性常常同时伴有BRAF基因突变,治疗困难,预后差。CMS2经典型,以APC缺失突变和Wnt激活为特点,治疗效果良好,预后良好。CMS3代谢性,KRAS突变,治疗上抗EGFR不敏感,肿瘤容易复发,但是化疗效果敏感,总体生存期预后尚可。CMS4间质型,高发于左半结肠,由于TGF-β的激活和血管生成增强,容易发生远处转移,治疗上可考虑抗血管生成药物的靶向化疗,该型患者预后最差。