尽管Remestemcel-L之前已在加拿大、日本等多国获批上市,但在美国FDA的申请上市的道路可谓坎坷曲折。2020年4月,FDA已受理Remestemcel-L的BLA,同时授予该申请优先审评资格。虽然Remestemcel-L在2020年8月获得美国FDA肿瘤药物咨询委员会(ODAC)9:1的压倒性支持,但FDA最终驳回了Mesoblast的上市文件,拒绝批准其上市。拒绝的理由是:其采用的是单臂试验而不是随机试验,建议至少在成人和/或儿童中进行一项随机对照试验,以此作为疗效的补充信息。
下表为Remestemcel-L针对SR-aGVHD开展的临床:
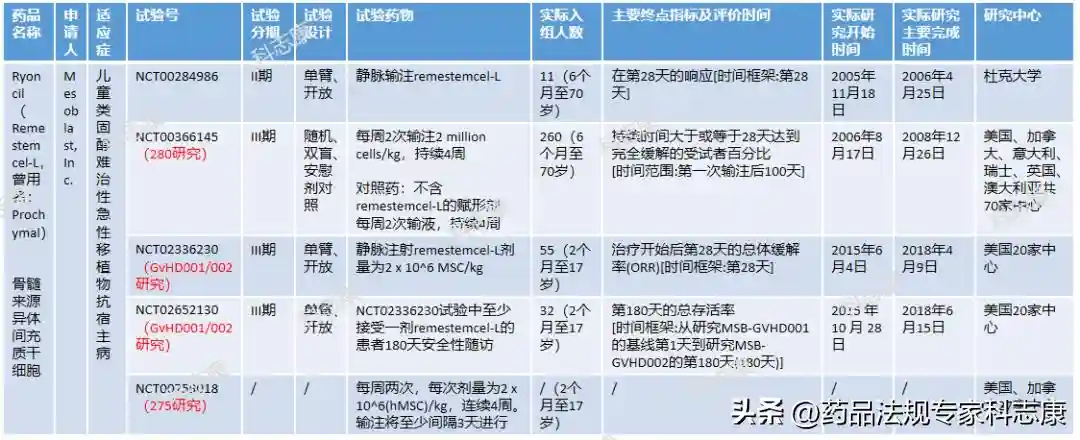
此次Mesoblast重新递交了临床试验新增数据,终于获得了FDA认可和受理,数据包括:
(1)对高危疾病儿童匹配性研究。对25位在PhaseIII中接受治疗的儿童和27位接受不同治疗的儿童进行比较。结果显示:在接受治疗28天内,接受Remestemcel-L治疗的高危儿童67%产生了积极应答,存活天数超过180天,对照组中仅有10%。
(2)PhaseIII中51位儿童患者的4年生存数据。结果显示:患者从2年预期生存率为25-38%改善为1年生存率为63%,2年生存率为51%,疗法效果显著。
在我国,以上市为目的的临床研究起于2004年,由中国医学科学院基础医学研究所申请,注册号为X0400586。近年来,NMPA也相继出台了《人源干细胞产品药学研究与评价技术指导原则(试行))》(2023年4月27日)、《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》(2023年6月21日)、《细胞治疗产品生产质量管理指南(试行)》(2022年10月31日)等法规政策。截至2023年7月31日,在CDE官网受理品种信息检索到72项以“干细胞”为研究药物的IND申请已获受理;在临床试验默示许可检索到45项以“干细胞”为研究药物的IND已获批;在《药物临床试验登记和信息公示平台》检索到29项以“干细胞”为研究药物的临床试验。尽管如此,我国仍然没有一项干细胞药物取得上市获批。西比曼是我国临床进展最快的一个间充质干细胞企业,在2023年7月12日公布临床试验信息。该项目的适应症是膝骨关节炎,为多中心、随机、双盲、对照III期临床试验。
除了Remestemcel-L之外,BrainStormCellTherapeuticsInc.(NASDAQ:BCLI)也在2023年3月27日宣布,开发的治疗肌肉萎缩(ALS)的干细胞药物NurOwn被FDA正式受理,并将PDUFA目标日期定为2023年12月8日。
历史文章:
胆管癌孤儿药,药捷安康「TT-00420片」纳入CDE突破疗法
蓝鸟公司基因治疗药物的CMC研究要点
和黄医药VEGFR抑制剂「呋喹替尼」纳入CDE突破疗法

2023年上半年国内获批上市新药复盘
HER2/3双抗zenocutuzumab一周连获2项FDA突破疗法
间充质干细胞获批难在哪里?从CMC角度解读上市要点和挑战

扫码关注
科志康
关于科志康
上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外79个知名制药企业建立合作,取得了100多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药